Toda la materia que conocemos, incluidos los cristales minerales, está formada por átomos, y todos los átomos están formados por tres partículas principales: protones, neutrones y electrones. Como se resume en la Tabla 2.1, los protones tienen carga positiva, los neutrones no tienen carga y los electrones tienen carga negativa. La carga -1 de un electrón equilibra la carga +1 de un protón. Tanto los protones como los neutrones tienen una masa de 1, mientras que los electrones casi no tienen masa.
Tabla 2.1 Cargas y masas de las partículas de los átomos
El elemento hidrógeno tiene los átomos más simples, cada uno con un solo protón y un electrón. El protón forma el núcleo, mientras que el electrón orbita a su alrededor. Todos los demás elementos tienen neutrones además de protones en su núcleo, como el helio, que se representa en la figura 2.1.1. Los protones cargados positivamente tienden a repelerse, pero los neutrones ayudan a mantener unido el núcleo. El número de protones es el número atómico, y el número de protones más neutrones es la masa atómica. En el caso del hidrógeno, la masa atómica es 1 porque hay un protón y ningún neutrón. Para el helio, es 4: dos protones y dos neutrones.
En la mayoría de los 16 elementos más ligeros (hasta el oxígeno), el número de neutrones es igual al de protones. En la mayoría de los elementos restantes, hay más neutrones que protones porque se necesitan neutrones adicionales para mantener unido el núcleo, superando la repulsión mutua del creciente número de protones concentrados en un espacio muy pequeño. Por ejemplo, el silicio tiene 14 protones y 14 neutrones. Su número atómico es 14 y su masa atómica 28. El isótopo más común del uranio tiene 92 protones y 146 neutrones. Su número atómico es 92 y su masa atómica es 238 (92 + 146).
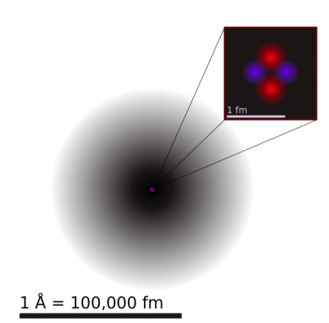
En la figura 2.1.1 se representa un átomo de helio. El punto del centro es el núcleo, y la nube que lo rodea representa dónde podrían estar los dos electrones en cualquier momento. Cuanto más oscura es la sombra, más probable es que un electrón esté allí. El átomo de helio mide aproximadamente 1 angstrom. Un angstrom (Å) equivale a 10-10 metros (m). El núcleo de helio mide aproximadamente 1 femtómetro. Un femtómetro (fm) equivale a 10-15 m. En otras palabras, la nube de electrones de un átomo de helio es unas 100.000 veces mayor que su núcleo.
Los electrones que orbitan alrededor del núcleo de un átomo se organizan en capas, también llamadas «niveles de energía». La primera envoltura sólo puede contener dos electrones, mientras que la siguiente puede contener hasta ocho electrones. Las capas siguientes pueden contener más electrones, pero la capa más externa de cualquier átomo no puede contener más de ocho electrones. Como veremos, los electrones de la capa más externa desempeñan un papel importante en el enlace entre átomos.
Media Attributions
- Figure 2.1.1: Helium Atom QM. © Yzmo. CC BY-SA.
Ir a 2.0 Introducción
Ir a 2.2 Enlaces y redes