Como acabamos de ver, para ser atómicamente estable, un átomo debe tener la corteza externa llena (es decir, ocho electrones para la mayoría de los elementos, o dos electrones para el hidrógeno y el helio). Esto se consigue transfiriendo o compartiendo electrones con otros átomos.
El sodio tiene 11 electrones: dos en la primera capa, ocho en la segunda y uno en la tercera (figura 2.2.1). El sodio cede fácilmente ese único electrón de la tercera capa y, cuando pierde esta carga negativa, se carga positivamente (porque ahora tiene 11 protones y sólo 10 electrones). Al renunciar a su único electrón de la tercera corteza, el sodio acaba teniendo la corteza externa llena. El cloro, por su parte, tiene 17 electrones: dos en la primera capa, ocho en la segunda y siete en la tercera. El cloro acepta fácilmente un octavo electrón para llenar su tercera capa y, por tanto, se carga negativamente porque tiene 17 protones y 18 electrones. Al cambiar su número de electrones, estos átomos se convierten en iones: el sodio pierde un electrón para convertirse en un ion positivo o catión, y el cloro gana un electrón para convertirse en un ion negativo o anión (figura 2.2.1).
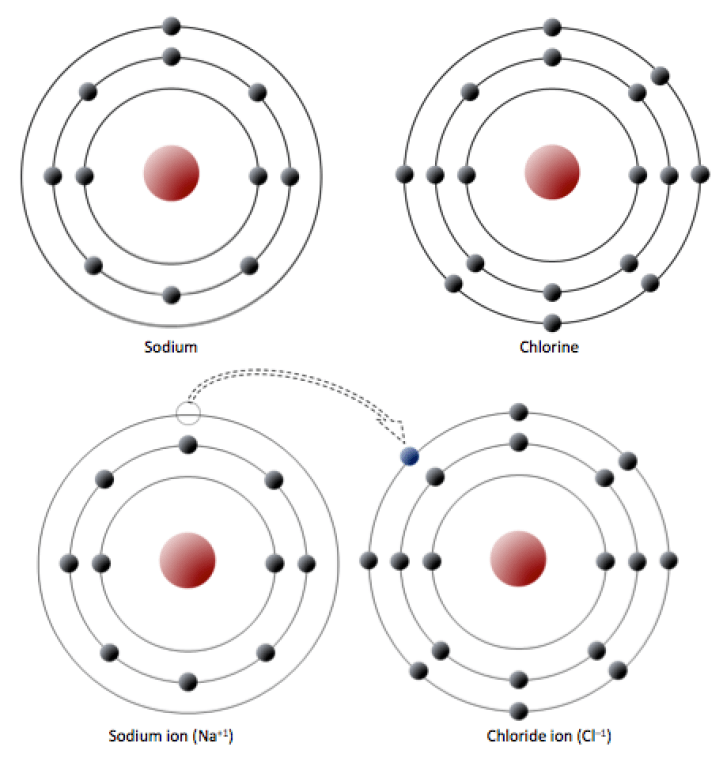
Dado que las cargas negativas y positivas se atraen, los iones de sodio y cloro pueden unirse, creando un enlace iónico. Se puede pensar que los electrones se transfieren de un átomo a otro en un enlace iónico. La sal de mesa común (NaCl) es un mineral compuesto de cloro y sodio unidos por enlaces iónicos (Figura 1.4.1). El nombre mineral del NaCl es halita.
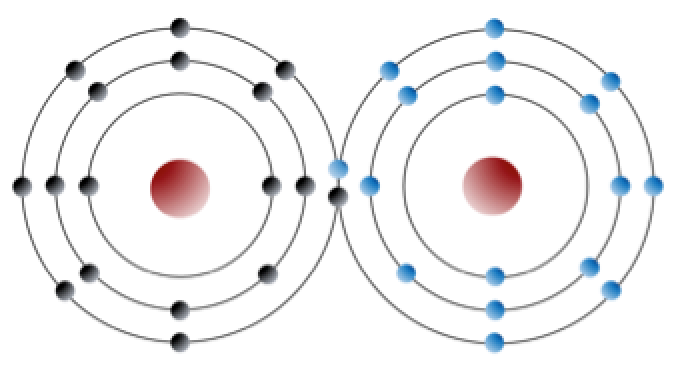
Un elemento como el cloro también puede formar enlaces sin formar iones. Por ejemplo, dos átomos de cloro, que buscan cada uno un octavo electrón en su capa externa, pueden compartir un electrón en lo que se conoce como enlace covalente para formar cloro gas (Cl2) (Figura 2.2.2). Los electrones se comparten en un enlace covalente.
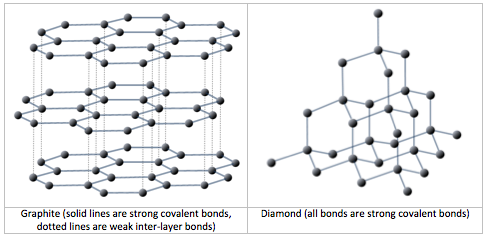
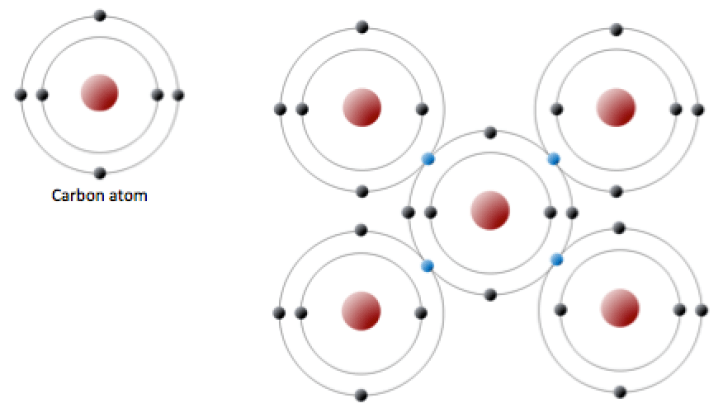
Un átomo de carbono tiene seis protones y seis electrones; dos de los electrones están en la capa interna y cuatro en la externa (Figura 2.2.3). El carbono necesitaría ganar o perder cuatro electrones para tener una capa exterior llena, lo que crearía un desequilibrio de carga demasiado grande para que el ion fuera estable. Por otro lado, el carbono puede compartir electrones para crear enlaces covalentes. En el mineral diamante, los átomos de carbono están unidos en una estructura tridimensional, en la que cada átomo de carbono está unido a otros cuatro átomos de carbono y cada enlace es un enlace covalente muy fuerte. En el mineral grafito, los átomos de carbono están unidos entre sí en láminas o capas (figura 2.2.3), y cada átomo de carbono está unido covalentemente a otros tres. Los compuestos a base de grafito, que son resistentes gracias al fuerte enlace covalente intracapa, se utilizan en equipos deportivos de alta gama, como las bicicletas de carreras ultraligeras. El grafito en sí es blando porque la unión entre estas capas es relativamente débil, y se utiliza en diversas aplicaciones, como lubricantes y lápices.
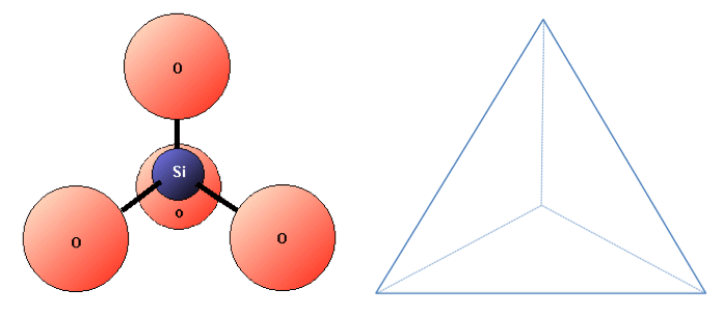
El silicio y el oxígeno se unen para crear un tetraedro de sílice, que tiene forma de pirámide de cuatro lados con O en cada esquina y Si en el centro (figura 2.2.4). Esta estructura es el componente básico de los minerales de silicato (que se describen en el apartado 2.4). Los enlaces en un tetraedro de sílice tienen algunas de las propiedades de los enlaces covalentes y algunas de las propiedades de los enlaces iónicos. Como resultado del carácter iónico, el silicio se convierte en un catión (con una carga de +4) y el oxígeno en un anión (con una carga de -2). La carga neta de un tetraedro de sílice (SiO4) es: 4 + 4(-2) = 4 – 8 = -4. Como veremos más adelante, los tetraedros de sílice (plural de tetraedro) se unen de diversas maneras para formar la mayoría de los minerales comunes de la corteza.
La mayoría de los minerales se caracterizan por tener enlaces iónicos, covalentes o una combinación de ambos, pero hay otros tipos de enlaces que son importantes en los minerales, como los enlaces metálicos y las fuerzas electrostáticas más débiles (enlaces de hidrógeno o de Van der Waals). Los elementos metálicos tienen electrones exteriores que se mantienen relativamente sueltos. (Los metales aparecen resaltados en la tabla periódica del Apéndice 1.) Cuando se forman enlaces entre dichos átomos, estos electrones pueden moverse libremente de un átomo a otro. Un metal puede considerarse como un conjunto de núcleos atómicos cargados positivamente inmersos en un mar de electrones móviles. Esta característica explica dos propiedades muy importantes de los metales: su conductividad eléctrica y su maleabilidad (pueden deformarse).
Las moléculas unidas iónica o covalentemente también pueden tener otras fuerzas electrostáticas más débiles que las mantienen unidas. Ejemplos de ello son la fuerza que mantiene unidas las láminas de grafito y la atracción entre las moléculas de agua.
Los elementos que tienen la corteza exterior llena se denominan inertes porque no tienden a reaccionar con otros elementos para formar compuestos. Esto se debe a que no necesitan perder ni ganar electrones para ser estables, por lo que no se convierten en iones. Todos ellos aparecen en la columna de la extrema derecha de la tabla periódica. Algunos ejemplos son: helio, neón, argón, etc.
Como se describió en el Capítulo 1, todos los minerales se caracterizan por un patrón tridimensional específico conocido como red o estructura cristalina. Estas estructuras van desde el sencillo patrón cúbico de la halita (NaCl) (figura 1.4.1), hasta los patrones muy complejos de algunos minerales de silicato. Dos minerales pueden tener la misma composición, pero estructuras cristalinas y propiedades muy diferentes. El grafito y el diamante, por ejemplo, están compuestos únicamente de carbono, pero mientras que el diamante es la sustancia más dura que se conoce, el grafito es más blando que el papel. En la figura 2.2.5 se comparan sus estructuras reticulares.
Los entramados minerales tienen importantes implicaciones en las propiedades de los minerales, como demuestran la dureza del diamante y lo blando del grafito. Las retículas también determinan la forma en que crecen los cristales minerales y cómo se rompen. Por ejemplo, los ángulos rectos de la red del mineral halita (figura 1.4.1) influyen tanto en la forma de sus cristales (cúbicos) como en el modo en que éstos se rompen (figura 2.2.6).

Referencias imágenes:
- Figuras 2.2.1, 2.2.2, 2.2.3, 2.2.4, 2.2.5 and 2.2.6 (right): © Steven Earle. CC BY.
- Figura 2.2.6 (left): Halite. © Rob Lavinsky, iRocks.com. CC BY-SA.